Глава III.5.
Электронная и атомная структура изомеров эндо- и экзоэдральных комплексов
фуллеренов с двумя атомами лития
С момента открытия
фуллеренов было получено и экспериментально исследовано большое количество их
производных, в частности - комплексов с металлами [1-9]. В настоящее время в
литературе широко представлены работы, освещающие изменения электронной
структуры, в зависимости от природы итнеркаллируемых атомов и их количества
[9-19]. Однако, на данный момент, достаточно мало изучены изомеры комплексов
фуллеренов с металлами. Были получены и исследовались как теоретически, так и
экспериментально экзо- и эндоэдральные комплексы с различным количеством атомов
лития [1,15-17,19]. Однако, влияние координации лития в экзо- и в эндоэдральных
соединениях на электронную структуру металлокомплексов не рассматривалось.
Расчеты электронной структуры, приведенные в данной статье, проводились
полуэмпирическими методами (MNDO), и неэмпирическим методом Хартри – Фока (базисный
набор 3-21G), с использованием программ: GAMESS [20] (неэмпирические расчеты) и
HyperChem 5.02. (полуэмпирические расчеты).
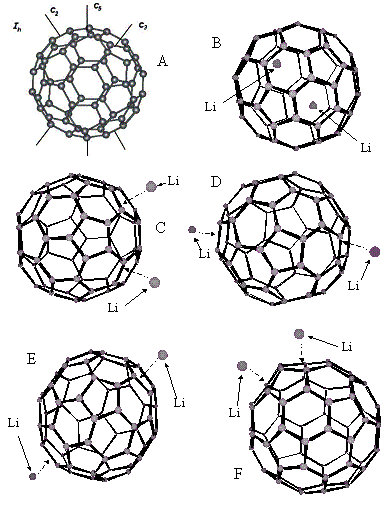
В ходе работы изучались всевозможные
эндо- и экзоэдральные металлокомплексы С60 с двумя атомами лития (Li2@C60
и Li2C60 соответственно) (Рис 5.1).
|
|
Рисунок
5.1. Молекула С60 и различные
изомеры комплексов фуллерена с двумя атомами лития. A) Молекула С60; B) Эндоэдральный комплекс Li2@С60; C) Экзоэдральный комплекс, в котором атомы лития координированы над наиболее
близко расположенными пятиугольниками (5AC.hin); D) Экзоэдральный комплекс, в котором атомы лития координированы над наиболее
удаленными друг от друга шестиугольниками (6AN.hin); E) Экзоэдральный комплекс, в котором атомы лития координированы над наиболее
удаленными друг от друга пятиугольниками (5AN.hin); F) Экзоэдральный комплекс, в котором атомы лития координированы над наиболее
близко расположенными шестиугольниками (6AC.hin); G) Диаграмма Шлегеля для изомеров экзоэндральных комплексов
Li2C60 с координацией лития над двумя пятиугольниками. Им
соответствуют три файла 5*.hin (см. Databank/Isomers _ Li), заглавные буквы в названии файлов указывают на
пару пятиугольников, возле которых располагаются атомы лития; H) Диаграмма Шлегеля для изомеров экзоэндральных комплексов Li2C60
с координацией лития над двумя шестиугольниками или над шести и пятиугольником.
Им соответствуют девять файлов 6*.hin (см. Databank/Isomers _ Li), заглавные буквы в названии файлов указывают на
пару многоугольников, возле которых располагаются атомы лития. |
|
G
|
H
|
|
Был рассмотрен только один эндоэдральный
комплекс с геометрией соответствующей состоянию с минимальной энергией. В нем атомы
лития размещались возле центра фуллерена вдоль оси С2, образуя димер Li2 (расстояние между литиями
~3Å) (Рис. 5.1b). Кроме того, были рассчитаны 12 различных
изомеров экзоэдрального комплекса (Рис.
5.1c-f). Отличие между ними заключалось в расположении атомов металла над различными
гранями углеродного полиэдра. При этом в качестве места координации литиев рассматривались
все возможные сочетания многоугольников, составляющих сферическую молекулу С60.
Все экзоэндральные комплексы можно разбить на три группы, в зависимости от того,
возле каких многоугольникав расположены литии. В первой группе, атомы щелочного
металла координировались около пятиугольников (три изомера), во второй – возле шестиугольников
(пять изомеров) и смешанная комбинация, в которой один из атомов лития располагался
над пятиугольником, а второй над шестиугольником (четыре изомера). В каждой группе
изомеры различались удаленностью друг от друга многоугольников, над которыми координировались
атомы металла (Рис.
5.1c-f). Необходимо отметить, что проводилось изучение экзоэдральных комплексов
с положением атомов лития около ребер и вершин полиэдра. Однако, в ходе оптимизации
геометрии атомы щелочного металла меняли свое положение, располагаясь над центрами
искаженных многоугольников, при этом расстояние от атома металла до плоскости многоугольника
составляло ~2.3Å.
Искажение
высокосимметричной углеродной основы комплекса наблюдалось для всех изучаемых
комплексов, при этом в правильных многоугольниках, характерных для молекулы С60,
происходило неэквивалентное увеличение расстояний между атомами углерода.
Для описания электронной структуры
молекул были построены полные и парциальные электронные плотности состояний, которые
сравнивались с экспериментально полученными фотоэлектронными спектрами [19]. Сравнение
спектров валентной зоны показало совпадение результатов как неэмпирических, так
и полуэмпирических расчетов с экспериментальными спектрами. В тоже время использование
полуэмпирических методов позволяет достаточно хорошо описывать геометрию фуллеренов,
поскольку получаемые в ходе полуэмпирических расчетов величины межатомных расстояний
и валентных углов более близки к экспериментальным значениям по сравнению с результатами
неэмирических (базис 3-21G) вычислений [19]
(см. также предыдущую главу и директорию Fullerens_ab initio).
Для исследуемых комплексов расчеты
осуществлялись как для синглетных, так и для триплетных состояний. Во всех рассматриваемых
случаях синглетные состояния комплексов оказались ниже по энергии триплетных аналогов.
При присоединении к молекуле
фуллерена атомов лития снимается многократное вырождение электронных уровней, характерное
для С60. Это объясняется значительным понижением симметрии получаемых
молекул по сравнению с исходной высокосимметричной молекулой С60. Вследствие
этого, ранее вырожденные энергетические уровни углеродной основы оказались в комплексах
сгруппированными в пакеты. Различие по энергии между уровнями в пакете, в зависимости
от симметрии изомера, составляла ~0.01-0.5eV, что в некоторых случаях приводило к смешиванию
пакетов в области потолка валентной зоны. Помимо различий в симметрии между металлокомплексами
и С60, в сдвиг уровней вносит вклад влияние положительного заряда атомов
лития. В комплексах фуллеренов с щелочными металлами происходит перенос электронов
с металла на углеродную часть молекулы,. в результате она приобретает отрицательный
заряд, а атомы лития – положительный ( заряд каждого из ионов лития составляет
~0.6). Таким образом, в качестве модели изучаемых металлокомплексов можно рассматривать
фуллерен с дополнительной парой электронов, находящийся в положительном поле ионов
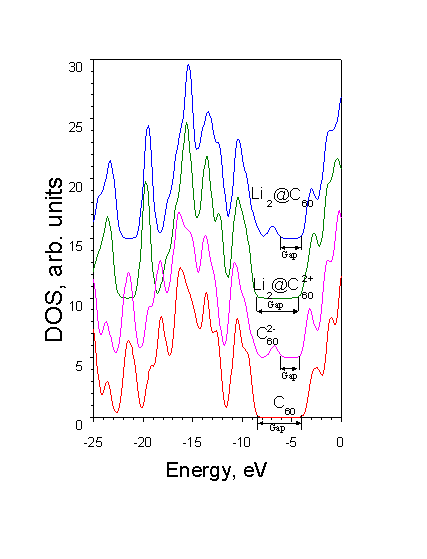
металла. Для подтверждения данной модели, проводился расчет системы Li2@C![]() . Сравнительный анализ полных плотностей состояний ионов и изомеров
металлокомплекса показал, что энергетические уровни ионов располагаются ниже подобных
уровней комплексов. Однако, после совмещения по энергии, их электронные структуры
практически совпадают (Рис.
5.2).
. Сравнительный анализ полных плотностей состояний ионов и изомеров
металлокомплекса показал, что энергетические уровни ионов располагаются ниже подобных
уровней комплексов. Однако, после совмещения по энергии, их электронные структуры
практически совпадают (Рис.
5.2).
|
|
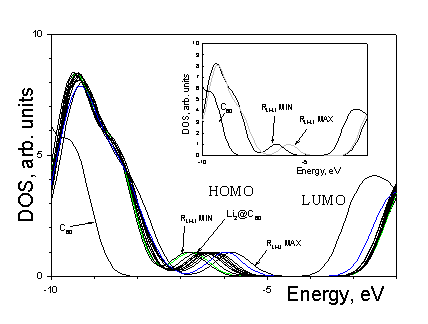
Рисунок 5.2. Полные электронные плотности состояний (снизу вверх) для С60 (красный), |
Еще одно отличие в электронной структуре
изучаемых металлокомплексов от молекулы С60 – это появление заполненного
уровня (внедренное состояние) располагающегося выше по энергии пакетов заполненных
уровней на величину ~1-3eV и ниже вакантных уровней на 3.5-5eV (абсолютное значение
внедренного состояния в исследуемых комплексах ~ -7eV). Появление внедренного состояния
объясняется присутствием на углеродной основе комплекса двух электронов атомов лития.
Для подтверждения проводился модельный расчет иона ![]() (синглет). Сравнительный
анализ (рис. 5.2) полных плотностей состояний модельного иона и одного из изомеров
комплекса с литием показал наличие в обеих структурах с дополнительной парой электронов
внедренного состояния.
(синглет). Сравнительный
анализ (рис. 5.2) полных плотностей состояний модельного иона и одного из изомеров
комплекса с литием показал наличие в обеих структурах с дополнительной парой электронов
внедренного состояния.
Верхний заполненный уровень в молекуле
С60 является пятикратно вырожденным связывающим состоянием (hu),
а нижний вакантный – трехкратно вырожденным антисвязывающим (t1u) (см. главу IV данной книги). В случае
синглетных состояний комплексов фуллеренов с двумя атомами лития, пара электронов
металла находится на одном из трех уровней, ранее принадлежавшим состоянию t1u,
которое расщепляется при присоединении атомов лития. Природа внедренного состояния
остается неизменной – это антисвязывающая орбиталь [22], что так же подтверждается
и отличиями пространственной структуры металлокомплексов фуллеренов от С60,
а именно увеличением межатомных расстояний в изомерах металлокомплексов (см. соответствующие файлы в директории Databank of structures/Isomers with Li). В молекуле С60, существует всего два типа
связей: одна проходит по ребрам шестиугольника и пятиугольника (6-5), длиной
~1.44Å, а вторая, длиной ~1.39Å, пролегает по ребрам двух
шестиугольников (6-6). В изучаемых комплексах большинство связей между атомами углерода
становится неэквивалентными. Увеличение межатомных расстояний между углеродами объясняется
тем, что во внедренное состояние, имеющее разрыхляющую природу, основной вклад вносят
орбитали углерода. Наибольшим изменениям в углеродной основе после образования металлокомплекса
подвергаются связи типа (6-6) (DRmax ~
0.1Å). Однако при рассмотрении всех изомеров, в большинстве случаев, связи
между шестиугольниками будут по-прежнему короче связей между шести- и пятиугольниками.
Отличия в электронной структуре
между различными изомерами металлокомплексов заключались в положении внедренного
состояния. В экзоэдральных комплексах при удалении атомов лития друг от друга на
наибольшее расстояние (Рис. 5.1D, 5.3, 5.4), внедренное
состояние максимально приближалось к вакантным уровням. В случае, когда атомы лития
размещались в соседних многоугольниках (Рисунок 5.1C, F), сдвиг внедренного состояния к пакету вакантных
уровней оказывался минимальным (Рис.
5.3, 5.4). Внедренные состояния для других изомеров Li2C60,
в том числе и для эндоэдрального комплекса, расположены между двумя описанными крайними
случаями. Расстояние между атомами лития в изомерах экзоэдральных комплексов играет
определяющую роль в положении внедренного состояния и, как следствие, ширины запрещенной
щели.
|
|
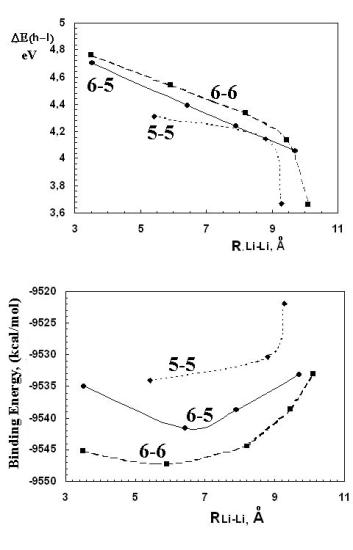
Рисунок 5.3. а) Зависимость ширины запрещенной щели от
расстояния между атомами лития, при его координации возле разных видов
многоугольников (пяти-, пятиугольник; шести-, шестиугольник; шести-,
пятиугольник). б) Зависимость энергии связи от
расстояния между атомами лития, при его координации возле разных видов многоугольников
(пяти-, пятиугольник; шести-, шестиугольник; шести-, пятиугольник). |
|
|
Рисунок 5.4. Полные электронные плотности состояний для различных
изомеров Li2С60. |
Как упоминалось выше, экзоэдральные
комплексы, возможно, разделить на три группы, в зависимости от координации ионов
лития над различными гранями полиэдра молекулы фуллерена.
В каждой из групп ширина запрещенной
зоны при увеличении расстояния между атомами лития убывает. Зависимость носит линейный
характер, за исключением двух отклонений – это изомеры, в которых литии находятся
друг от друга на максимальном удалении. В двух последних случаях (атомы лития координируются
возле противоположных многоугольников, в одном случае возле пяти-, а в другом шестиугольников)
наблюдается резкое уменьшение ширины запрещенной зоны.
Наши теоретические расчеты с высокой
точностью подтверждаются экспериментальными фотоэлектронными спектрами [23].
|
|
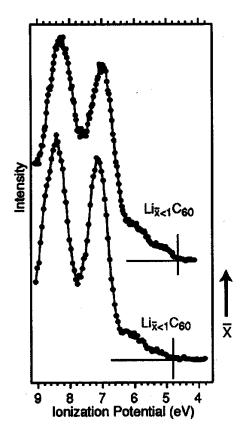
Рисунок 5.5. Экспериментальные [23] фотоэлектронные спектры
валентной полосы комплексов LixС60
(х<1, степень допирования х растет к верху). Видно, что
внедренное состояние имеет сложную форму и состоит из ряда пиков. Авторы
отнесли такое строение внедренного состояния к проявлению смеси фаз.
Вертикальная полоса отмечает уровень Ферми. |
На Рисунке 5.5 представленны экспериментальные [23] фотоэлектронные спектры валентной
полосы комплексов LixС60
(х<1, степень допирования х растет к верху). Видно, что внедренное
состояние имеет сложную форму и состоит из ряда пиков. Авторы отнесли такое
строение внедренного состояния к проявлению смеси фаз. Вертикальная полоса
отмечает уровень Ферми. Ширина всей полосы в экспериментальных спектрах
составляет порядка 2 эВ, а в наших расчетах, с учетом всех возможных изомеров –
около 1.5 эВ.
Полная энергия экзоэдральных комплексов, как и ширина
запрещенной щели, зависит от того, над какими многоугольниками располагаются ионы
лития и от расстояния между ними. В каждой группе изомеров при увеличении расстояния
между литиями происходит увеличение полной энергии. Исключениями в данном случае
являются изомеры, в которых атомы лития находятся в соседних многоугольниках (два
шестиугольника либо расположенные рядом шести- и пятиугольники). Увеличение полной
энергии для данных комплексов вероятнее всего связано с сильным электростатическим
отталкиванием положительно заряженных литиев.
СПИСОК ЛИТЕРАТУРЫ К ГЛАВЕ III.5.
[1] N. Krawez, A. Gromov, R.
Tellgmann, E.E.B. Campbell, Electronic properties of novel materials - Progress
in molecular nanostructures, XII International Winterschool, Kirchberg, Tyrol,
Austria, 1998, p. 368.
[2] Y. Yoshinari, H. Alloul,
V. Brouet, G. Kriza, K. Holczer, L. Forro, Phys. Rev. B54, 6155 (1996).
[3] T. Pichler, M.S. Golden,
M. Knupfer, J. Fink, XII International Winterschool Electronic properties of
novel materials, Proceedings, edt. by H. Kuzmany, 271 (1998).
[4] D.M. Poirier, M.
Knupfer, J.H. Weaver, W. Andreoni, K. Laasonen, M. Parinello, D.S. Bethune,
K.Kikuchi, Y. Achida, Phys.Rev. B49, 17403 (1994).
[5] J.H. Weaver, Acc. Chem.
Res. 25, 143 (1992).
[6] M.Takata, B.Umeda,
E.Nishibori, M.Sakata, Y.Saito, M.Ohno, H.Shinohara, Nature, 377, 46 (1995).
[7] W. Sato, K. Sueki, K. Kikuchi,
S. Suzuki, Y. Achiba, H. Nakahara, Y. Ohkubo, K. Asai, F. Ambe, Phys.Rev. B58,
p. 10850 (1998).
[8] C. Gu, F. Stepniak, D.M.
Poirier, M.B. Jost, P.J. Benning, Y.
Chen, T.R. Ohno, J.J.L. Martins, J.H. Weaver, J. Fure, R.E. Smalley, Phys. Rev. В53,
1196 (1995).
[9] А.В Елецкий., Б.М. Смирнов,
УФН.-1995.-Т. 165, № 9.-С. 977-1009.
[10] H.W. Kroto, J.R. Heath,
S.O. O’Brien et al. C60: Buckminsterfullerene // Nature.-1985.-Vol.
318.-P. 162-163.
[11] M.Takata, B.Umeda, E.Nishibori,
M.Sakata, Y.Saito, M.Ohno, H.Shinohara, Nature, 377, 46 (1995).
[12] S. Patchkovskii, W.
Thiel, J.Chem. Phys., 106, 1796 (1997).
[13] C.G. Joslin, J. Yang,
C.G. Gray et.al., Chem. Phys. Let., 211, 587 (1993)
[14] L. Pang, F. Brisse, J.
Phys. Chem., 97, 8562 (1993).
[15] C.G. Joslin, J. Yang,
C.G. Gray et.al., Chem. Phys. Let., 208, 86 (1993)
[16] J. Chioslovski, E.D.
Fleischmann, J. Chem. Phys., 94, 3730 (1991).
[17] J.L. Ballester, B.I.
Dunlop, Phys. Rev. A45, 7985 (1992).
[18] А.Б. Ройцин, Л.В. Артамонов, А.А. Климов, ФНТ 23, 1112 (1997).
[19] С.А. Варганов, П.В. Аврамов,
С.Г. Овчинников. Физика твердого тела, т. 55, 378 (2000).
[20] M.W. Schmidt,
K.K. Baldridge, J.A. Boatz, S.T. Elbert, M.S. Gordon, J.H. Jensen, S. Koseki,
N. Matsunaga, K.A. Nguyen, S.J. Su, T.L. Windus, M. Dupuis, J.A. Montgomery, J.
Comp. Chem.-1993-14-P.1347-1363.(GAMESS)
[21] J.H. Weaver, Acc. Chem.
Res. 25, 3, 143 (1992).
[22] Бочвар Д. А., Гальперн Е. Г., Докл. АН СССР, 209, 610
(1973).
[23] Schnadt J., Bruhwiler
P.A., Martensson N., Lassesson A., Rohmund F., Campbell E.E.B., Phys. Rev.
B62, 4253-4256